Comment le CO₂ se solidifie dans le béton et le ciment
Pour parvenir à un stockage solide du CO₂ à grande échelle dans du béton et du ciment, il est nécessaire comprendre le détail chimique de sa carbonatation. Des chercheurs et chercheuses ont établi le mécanisme complet de la minéralisation du CO₂ dans les nanopores du béton. Publiés dans la revue Nature Communications, ces travaux combinent des simulations à l’échelle moléculaire de type « metadynamics » couplées à des expériences de laboratoire.
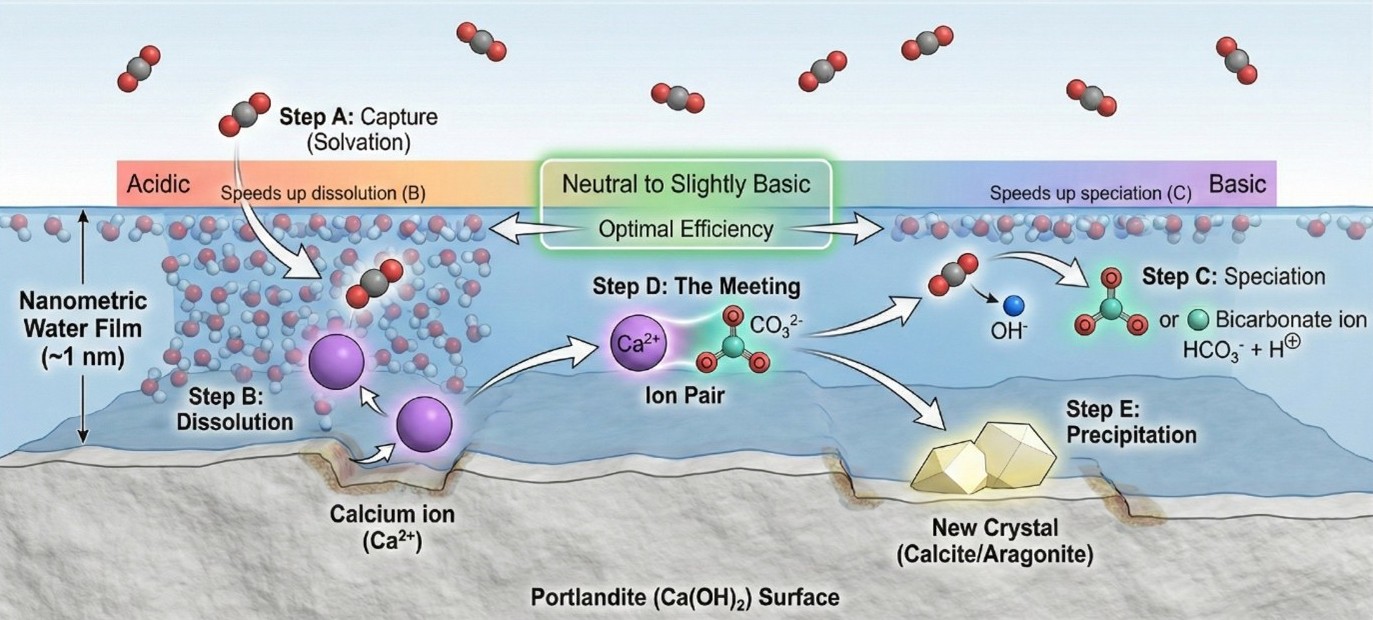
Une des manières les plus sûres de stocker le CO₂ consiste à le solidifier sous forme de carbonates. Il réagit alors avec des minéraux riches en calcium pour former des carbonates très stables, tels que le calcaire. Avec un potentiel à l’échelle de la gigatonne, le stockage du carbone sous forme de carbonates à partir de ciment et de béton, offre une voie prometteuse pour atteindre les objectifs de neutralité carbone. Les matériaux cimentaires sont particulièrement intéressants car ils sont alcalins, riches en calcium et omniprésents. La carbonatation a lieu dans les pores capillaires de la pâte de ciment (50-1000 nm), plus précisément dans le film d’eau à leur surface dans les conditions optimales. Des chercheurs et chercheuses du Laboratoire de mécanique et génie civil (LMGC, CNRS/Univ. Montpellier), du laboratoire Navier (CNRS/ENPC/Univ. Gustave Eiffel), de l’Institut européen des membranes (IEM, CNRS/ENSC Montpellier/Univ. Montpellier) et de l’Université polytechnique de Hong Kong (Chine) ont montré que ce film d’eau nanométrique n’est pas une couche passive : il agit comme un « nanoréacteur » qui concentre les réactifs à l’interface, soit le calcium et le CO₂ en conditions modérément basiques, et établit des conditions chimiques locales qui favorisent les premières étapes de la minéralisation.
Grâce à la simulation moléculaire, ces scientifiques ont élucidé pour la première fois le panorama complet de la minéralisation du CO₂ sur des surfaces de portlandite en milieu confiné et nanohumide, représentatives des phases cimentaires. Le spectre de minéralisation est la cartographie quantitative du parcours thermodynamique complet d’une molécule de CO₂, depuis la phase gazeuse à sa solidification. L’équipe a quantifié la thermodynamique des cinq grandes étapes. D’abord l’adsorption de l’eau et la formation du film nanométrique. Ensuite vient la dissolution du calcium, qui s’accompagne de la libération des ions calcium depuis les défauts de surface du réseau cristallin. Puis l’adsorption du CO₂ et sa capture par le film d’eau. On passe après à la spéciation du CO₂, qui est sa conversion, via des équilibres acido-basiques, en espèces bicarbonate/carbonate. Cette étape est identifiée comme l’étape limitante en raison de barrières énergétiques élevées. Enfin, on termine par la phase d’appariement ionique, où se forment des paires d’ions calcium-carbonate, précurseurs du carbonate de calcium. En résolvant ce spectre, les chercheurs et les chercheuses ont identifié une série de réactions énergiquement favorable où ces étapes s’autoentretiennent. Ils ont également démontré que des conditions neutres à légèrement basiques sont optimales pour ce processus, ce qui ouvre la voie à des procédés industriels plus efficaces pour recycler les déchets de béton en puits de carbone.
L’industrie peut en effet à présent optimiser ses procédés pour carbonater massivement les gravats de béton de démolition avant de les réutiliser. Car une fois le CO2 dissous dans le film d’eau, il réagit chimiquement pour devenir du carbonate. Ce carbonate va alors chercher le calcium, libéré par la portlandite du ciment, pour s’y « coller ». C’est cette réaction qui crée la pierre, le calcaire, rendant le stockage effectif et permanent. Le stockage à grande échelle est chimiquement inévitable si l’on regarde le cycle de vie du ciment. Car pour en fabriquer, on chauffe du calcaire, ce qui libère du CO2. Le mécanisme de carbonatation ici décrit est exactement l’inverse : le ciment hydraté réabsorbe le CO2 pour redevenir du calcaire. Le gisement est là : ce sont tous les bâtiments et infrastructures en béton existants qui constituent un puits de carbone massif et omniprésent.
Le principal verrou à lever tient au facteur temps, car, lorsqu’il se produit naturellement, le processus prend plusieurs décennies. En décryptant le fonctionnement intime du nanoréacteur formé par le film d'eau dans les pores, ces travaux ont identifié les conditions optimales pour maximiser l'efficacité de la réaction. Ainsi, les déchets de béton pourraient être transformés en puits de carbone en seulement quelques heures. L’équipe compte à présent aller au-delà des précurseurs, et ainsi comprendre comment les couples ioniques calcium-carbonate ainsi obtenus s’assemblent ensuite pour nucléer, puis former des carbonates. Elle va également tester la généralité de ces résultats à d’autres minéraux, notamment les silicates présents dans le ciment et les roches naturelles, ce qui étendrait le potentiel de stockage bien au-delà de la seule industrie du ciment.
© Zhu et al.
Références
Molecular mechanisms of CO2 mineralization on wetting nanoscale surfaces using molecular simulations and metadynamics.
Xinping Zhu, Yong Tao, Romain Dupuis, Yining Gao, Chi-Sun Poon, Katerina Ioannidou & Roland J-M Pellenq.
Nature Communications volume 16, Article number: 10758 (2025).
https://doi.org/10.1038/s41467-025-65794-w
