Cryogénisée puis greffée, la transformation de l’aorte en trachée
Longtemps récalcitrantes, la trachée et les bronches ne disposent d’un protocole de greffe fiable que depuis quelques années. L’opération, menée par des médecins des hôpitaux universitaires Paris Seine–Saint-Denis, utilise un segment d’aorte. Des chercheurs du laboratoire de Bioingénierie et bioimagerie ostéo-articulaire avaient étudié en amont la manière dont le greffon se transforme progressivement en trachée. Ces travaux sont publiés dans le Journal of the American Medical Association.
De 2009 à 2017, treize patients ont reçu une greffe de trachée, de bronche ou de carène, l’embranchement des bronches, aux hôpitaux universitaires Paris Seine–Saint-Denis. Huit d’entre eux respirent à présent normalement et sans aide. Cette première mondiale est apparue tardivement car l’utilisation d’une trachée pour en remplacer une autre entraîne une forte réponse immunitaire, trop lourde pour des patients généralement atteints d’un cancer. Des aortes ont donc été utilisées à la place. Des chercheurs du laboratoire de Bioingénierie et bioimagerie ostéo-articulaire (B2OA, CNRS/Université Paris Diderot) ont pour cela étudié le phénomène de différenciation, où les cellules de l’aorte du donneur sont progressivement remplacées par des cellules de trachées du receveur.
Afin de les stocker et de les garder disponibles, les aortes sont cryoconservées à -80°C. Première surprise, les chercheurs ont constaté que certaines cellules survivaient à l’opération. Des cultures in vitro ont montré que ces cellules possédaient des fonctions chimiotactiques et pro-angiogènes, c’est-à-dire qu’elles favorisent le développement de vaisseaux sanguins. L’évolution post opératoire du greffon a ensuite été suivie grâce à un chimérisme male/femelle, où l’on distingue les cellules du donneur et du receveur en s’assurant qu’ils soient de sexe différent. Les cellules du greffon aortique disparaissent progressivement, laissant place à une colonisation par les cellules du receveur. Trente-neuf mois après implantation, un examen histopathologique des greffons a révélé la régénération d’un épithélium respiratoire mixte ainsi que la présence par endroit de tissus cartilagineux, comme dans une trachée.
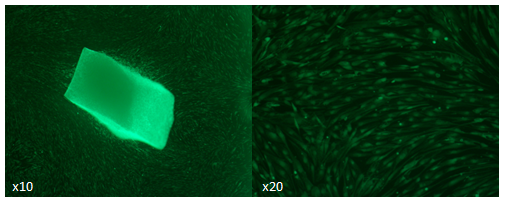
Prolifération cellulaire et viabilité à partir d’AAC après décongélation
Echantillons de biopsies obtenus à partir de l'allogreffe aortique Cryo-conservée (AAC) après décongélation. Afin de détecter les cellules viables dans l’AAC, l'explant de culture a été réalisé à partir de la biopsie d’AAC après décongélation. La prolifération cellulaire a été analysée par microscopie optique après addition de diacétate de fluorescéine. La culture cellulaire de l’explant montre que les cellules contenues dans l’AAC après décongélation sont viables et sont capables de proliférer.
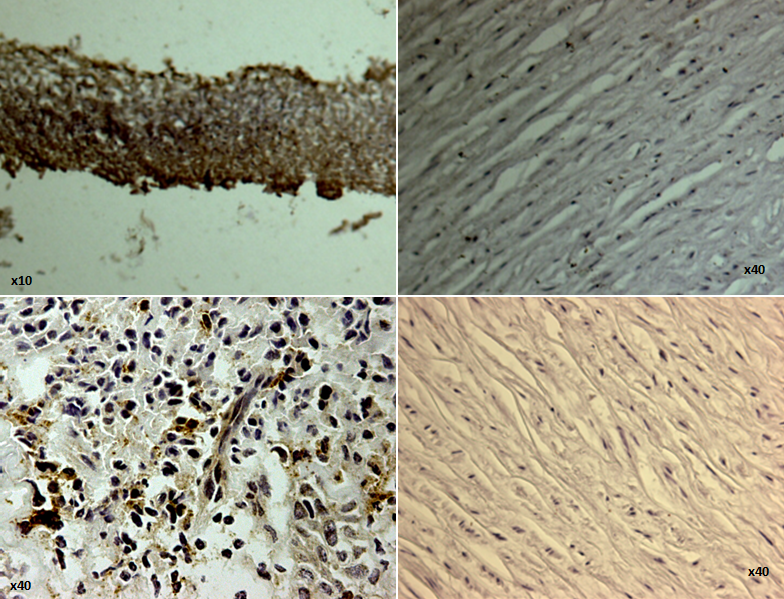
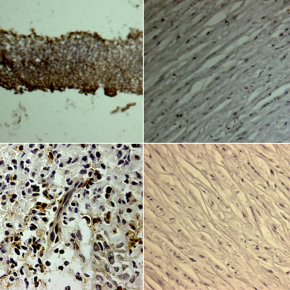
Échantillons de biopsies obtenus à partir de l'allogreffe aortique cryo-conservée (AAC) avant et 39 mois après transplantation trachéale
Les tissus identifiés comme néo-épithélium, néo-cartilage et granulome ont été isolés et utilisés pour des études histologiques afin d'étudier la génération de novo de cartilage dans les greffes aortiques des cellules receveuses. Le marquage avec des anticorps dirigés contre le collagène de type 2 et Sox9 (coloration brune) montre, 39 mois après implantation, que allogreffe aortique cryo-conservée présente de cellules ressemblant au cartilage. Avant implantation, l’allogreffe aortique cryo-conservée étaient négatives pour ces marqueurs.
Références :
Feasibility of Bioengineered Tracheal and Bronchial Reconstruction Using Stented Aortic Matrices,
E.l Martinod, K. Chouahnia, D. M. Radu, P. Joudiou, Y. Uzunhan, M. Bensidhoum, A. M. Santos Portela, P. Guiraudet, M. Peretti, M.-D. Destable, A Solis, S. Benachi, A. Fialaire-Legendre, H. Rouard, T Collon, J. Piquet, S. Leroy, N. Vénissac, J. Santini, C. Tresallet, H. Dutau, G. Sebbane, Y. Cohen, S. Beloucif, A. C. d’Audiffret, H. Petite, D. Valeyre, A. Carpentier and E. Vicaut
Journal of the American Medical Association 319(21):2212-2222 (2018)
DOI: 10.1001/jama.2018.4653