Reprogrammer des cellules immunitaires pour optimiser les stratégies d’immunothérapie
Contrôler le comportement des cellules immunitaires permet de traiter des cancers. Mais la réponse immunitaire obtenue est complexe et difficile à prévoir. Grâce à des nanoparticules métalliques, les laboratoires Nabi et LCBPT ont développé un test de criblage couplé à des techniques d'analyse statistique pour mieux comprendre comment et dans quelles directions les cellules immunitaires peuvent être reprogrammées. Ces résultats sont publiés dans la revue Advanced Science.
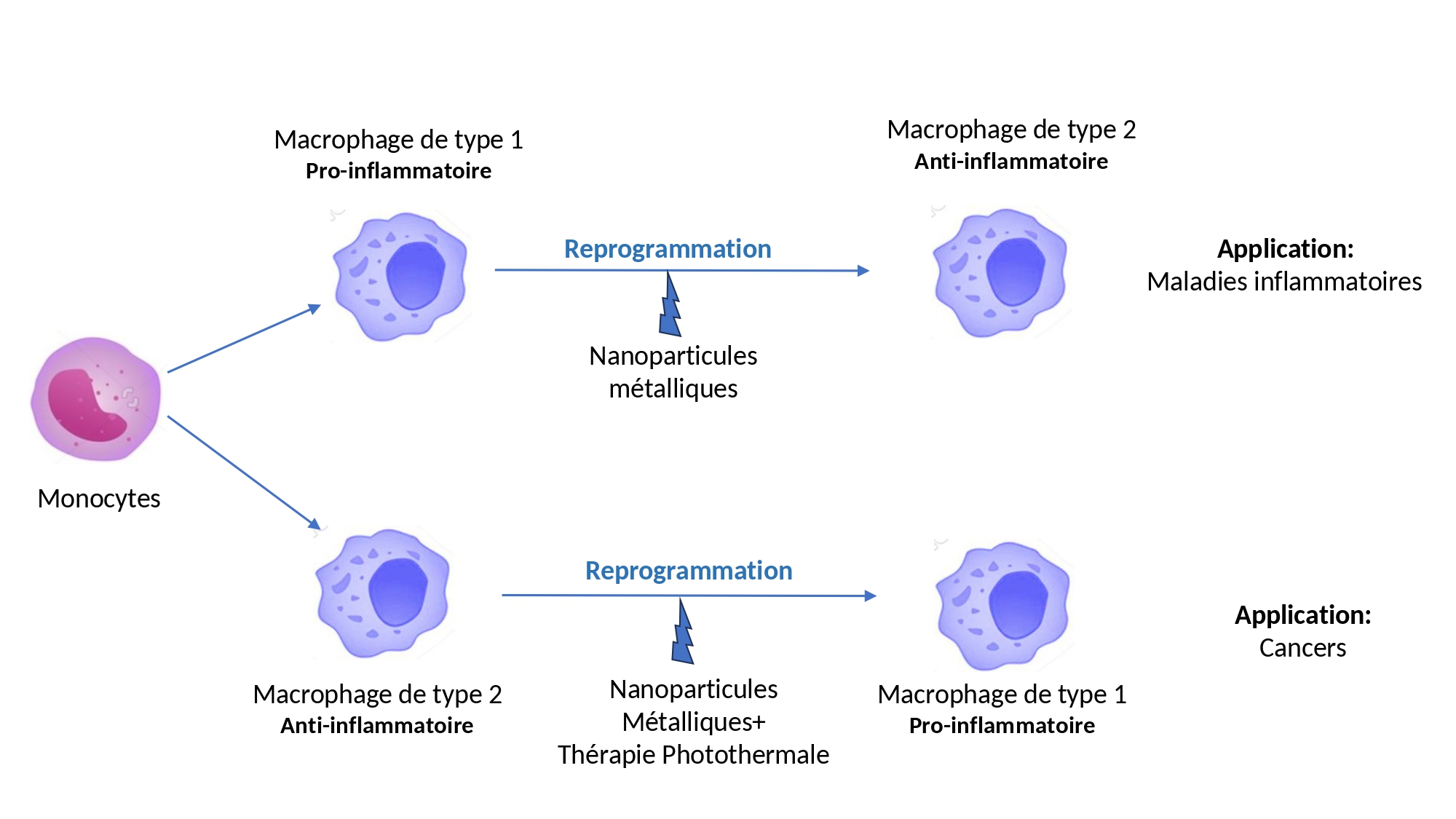
L'immunothérapie consiste à activer le système immunitaire du patient pour qu'il détruise les cellules cancéreuses. Dans ce but, les cellules immunitaires, les macrophages, peuvent être reprogrammées par différentes techniques, et notamment à l'aide de nanoparticules métalliques activées par laser. Mais le comportement des cellules immunitaires obtenues par ces traitements dépend de multiples facteurs et reste difficile à prévoir. C'est pourquoi, pour faciliter la mise au point de stratégies d'immunothérapie et améliorer leur efficacité, des chercheurs du laboratoire Nanomédecine, biologie extracellulaire, intégratome et innovations (NABI, CNRS/Inserm/Université Paris Cité) et du Laboratoire de chimie et biochimie pharmacologiques et toxicologiques (LCBPT, CNRS/Université Paris Cité), en collaboration avec le Laboratoire chrono-environnement (LCE, CNRS/Université Marie et Louis Pasteur), ont développé un test de criblage couplé à l'analyse statistique pour mieux comprendre comment et dans quelles directions les macrophages peuvent être reprogrammés par différents traitements.
L'immunologie classe les macrophages en deux catégories. Les macrophages M1 sont dits ''pro-inflammatoires'', et susceptibles de participer à l'élimination de cellules cancéreuses, tandis que les macrophages M2, ''anti-inflammatoires'', sont impliqués dans la régulation de la réponse immunitaire. Il existe en fait un spectre d'évolution entre ces deux pôles, et l'objectif est de faciliter le contrôle du comportement des cellules immunitaires en fonction de la thérapie que l'on veut appliquer. L'étude a été menée in vitro avec des macrophages polarisés en M1 ou M2, auxquels sont ajoutées des nanoparticules, activées ou non par un laser. Sept types de nanoparticules de compositions, de formes, et de distribution de tailles différentes, ont été testés. Ainsi, la présence de nanoparticules d'oxyde de fer décorées de nanoparticules d'or favorise la polarisation M2 des macrophages, tandis que leur chauffage par l'action d'un laser fait basculer leur comportement vers une polarisation M1.
L'analyse des résultats, à l'aide d'une technique statistique automatisée (Analyse en composantes principales), a permis d'établir une classification des réponses immunitaires obtenues avec différents types de nanoparticules et d'activation par laser. Cette méthode devrait aussi permettre de prédire l'effet d'un traitement sur la reprogrammation d'un macrophage et son utilisation possible dans une stratégie d'immunothérapie. Développée en utilisant des nanoparticules activées par laser, elle est applicable à la reprogrammation d’autres cellules immunitaires, telles que les cellules dendritiques ou les lymphocytes B.
L'équipe de scientifiques souhaite maintenant développer des études in vivo. Par ailleurs, les chercheurs envisagent également l'utilisation de nanoparticules d'origine biologique pour opérer la reprogrammation de macrophages.
© J.P. Herbeuval, LCBPT
Références
Multivariate Screening and Automated Clustering of Macrophage Immunoreactome to Nanoparticles and Photothermal Therapy.
Sonia Becharef, Léa Jabbour, Nassima Bekaddour, Giulio Avvedutto, Nathalie Luciani, Gautier Laurent, Rana Bazzi, Edouard Alphandery, Stéphane Roux, Amanda K. A. Silva, Kelly Aubertin, Jean-Philippe Herbeuval, Florence Gazeau.
Advanced Science, publié le 26 juin 2025.
https://doi.org/10.1002/advs.202405860